医薬品や検査診断薬などの研究開発において、開発分子とターゲットの相互作用の情報は必要不可欠です。東レリサーチセンターでは、表面プラズモン共鳴(SPR)や等温滴定カロリメトリー(ITC)、核磁気共鳴(NMR)、高速原子間力顕微鏡(高速AFM)等の種々の手法、さらにシミュレーションを活用した総合的な相互作用解析の実施が可能です。
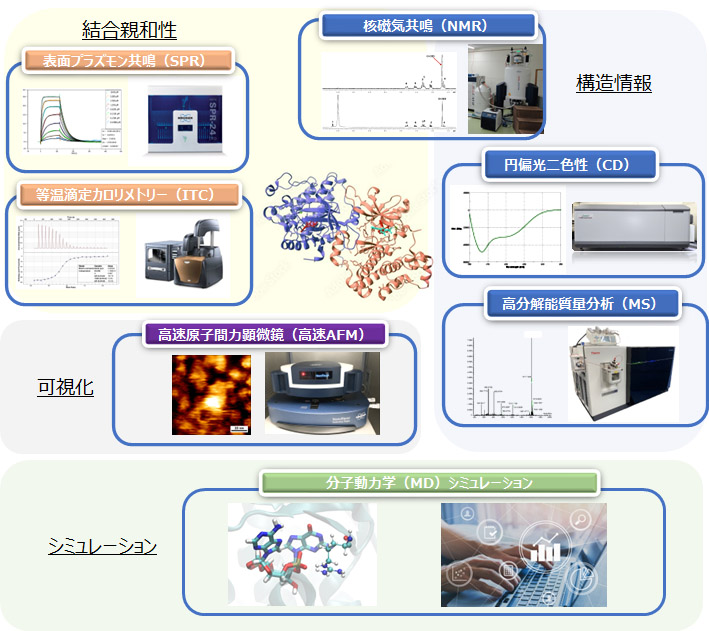
各手法で得られる情報は異なります。
例えば、SPRでは結合・解離の速度と結合親和性の強さの情報を、ITCでは熱力学的なパラメータから結合様式や結合比の情報を得ることができます。また、NMRからは、相互作用部位の情報を得ることが可能です。目的に応じて分析手法を選択します。
また手法によってサンプルの必要量が異なり、分子量制限もありますので、サンプル条件によっても手法を選択する必要があります。
弊社では、目的・サンプルに応じて、最適な手法をご提案します。
| 手法 | SPR | ITC | NMR | 高速AFM | |
|---|---|---|---|---|---|
| STD-NMR | 15N-HSQC perturbation | ||||
| 得られる情報 | 強さ、速さ | 強さ、 様式、比 |
強さ、 部位(低分子) |
強さ、部位 (タンパク質) |
表面凹凸(高さ)およびその変化、 相互作用の有無 |
| サンプル量 | 少 | 多 | 多 | 多 | 少 |
| スループット性 | 高 | 低 | 中~低 | 低 | 低 |
| 固定化・ ラベル化 |
要固定化 | 不要 | 不要 | タンパク質: 要ラベル化 |
要固定化 |
| 分子量制限 | リガンド:なし アナライト:>100 Da |
無 イオン~高分子 |
タンパク質:無 化合物:低分子 |
タンパク質:有 | リガンド:なし アナライト:中分子以上 |
| 「申請資料の信頼性の基準」対応 | 〇 | 〇 | 〇 | 〇 | × |
各手法の原理・特徴
分析事例
・SPRを用いた定量の事例
環状ペプチドなどの特殊なペプチドや合成難易度の高いペプチドもスピーディーに対応いたします。
表面プラズモン共鳴(SPR:Surface Plasmon Resonance)
「申請資料の信頼性の基準」対応
相互作用の動的プロセス(結合速度・解離速度)を分析するのに優れた手法
多検体の相互作用(強さ、速さ)を短時間で解析できる
原理
SPRはセンサーに結合させたリガンドとその表面を流れるアナライトの相互作用をリアルタイムに検出することができる手法です。
リガンドとアナライトの相互作用で生じた質量変化を反射光の屈折率変化として捉えます。
下図のようにリガンドに結合させたセンサーチップにアナライトを流すと、結合の様子を示すセンサーグラムが得られ、次に移動相を流すことで、解離の様子を示すセンサーグラムを取得することができます。
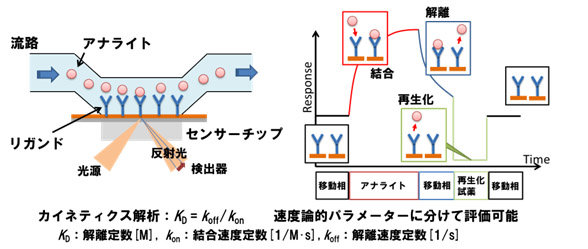
カイネティクス解析は、アフィニティーの強さを示す解離定数KDを算出するだけではなく、その結合の速さkonと解離の速さkoffの速度論的なパラメーターに分けて評価する解析法です。
リアルタイムに結合と解離の状態を検出できることが、SPRの特徴です。
弊社SPR分析の特徴( Bruker社 Sierra SPR-24 Pro )
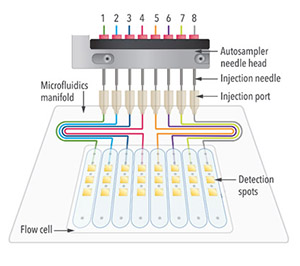
<特徴1>ハイスループット
- 24センサースポット(3 spots/channel x 8 channels)
- スポットごとに独立にリガンドを固定化、アナライトのインジェクションが可能
- 1回のインジェクションで24種のリガンドのスクリーニングが可能
<特徴2>高感度
- フラグメントなどの低分子化合物の相互作用解析が可能
- 分子量 ≥ 100 Da
分析例
<カルボニックアンヒドラーゼ(30k Da)-スルファモイル安息香酸(201 Da)>
タンパク質を固定化し、低分子化合物を濃度を変えて測定することで、下図に示したセンサーグラムが得られ、解析により、各パラメータが得られます。
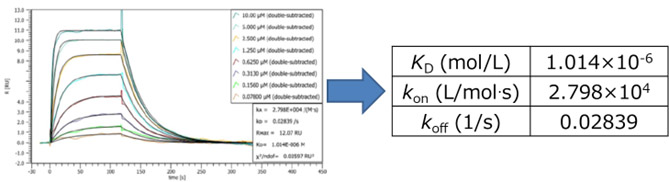
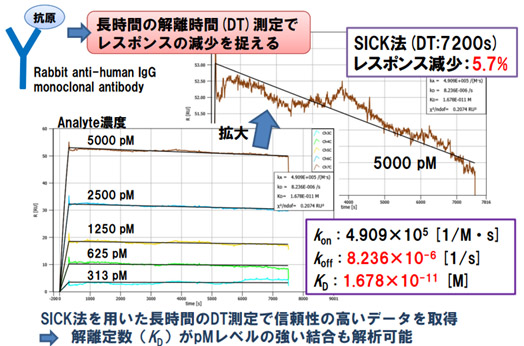
< SICK法を用いた高い親和性を有する抗体の解析>
SICK(Single Injection Cycle Kinetics)法は、同じリガンドを固定化した一連のセンサースポットに対して、スポットごとに濃度の異なるアナライト溶液をアプライし、迅速なカイネティクス解析が行える手法です。
再生が困難なリガンドや、容易に失活するリガンドの分析に適応可能で、また、通常のSPRの手法では正確な評価が難しい非常に強い結合を有する抗体についてのカイネティクス解析も可能な手法です。
等温滴定カロリメトリー(ITC:Isothermal Titration Calorimeter)
「申請資料の信頼性の基準」対応
相互作用の様式・比を分析するのに優れた手法
原理
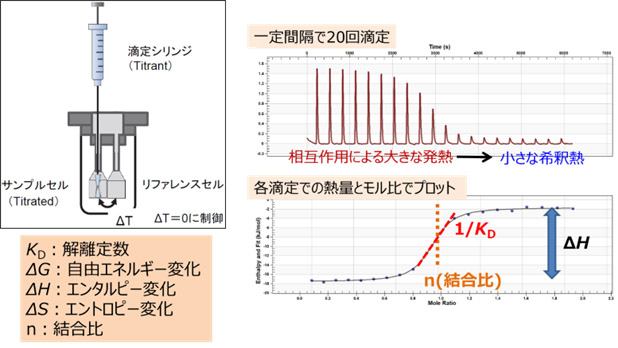
ITCは、サンプルセルと滴定シリンジに分析したい2成分をそれぞれ充填し、シリンジからセル内に一定間隔で滴定することで、滴下ごとの2物質間の相互作用で生じる熱変化を観測する手法です。
相互作用にともなう大きな発熱から、飽和に達して小さい発熱となる過程をプロットし、熱量変化を解析することで、結合の強さをはじめ、エンタルピーやエントロピーといった熱力学的なパラメータや結合比を求めることができます。
特徴
- 高感度な装置
- 非ラベル化、非固定化
より自然に近い状態での分析ができる - 結合様式(エンタルピー、エントロピー)
エンタルピー優勢 ⇒ 水素結合、静電相互作用
エントロピー優勢 ⇒ 疎水性相互作用 - 分子量の制限なし
サンプル例
- イオン、低分子、ペプチド、タンパク質、抗体などの各種相互作用
- 包摂(胆汁酸とシクロデキストリンなど)
- 臨界ミセル濃度(界面活性剤)
分析例
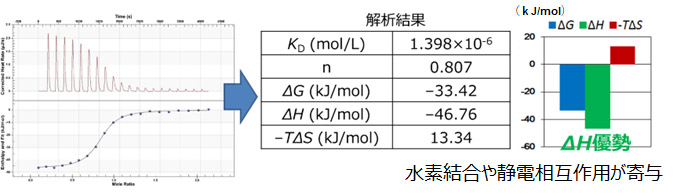
<カルボニックアンヒドラーゼ(30k Da)-スルファモイル安息香酸(201 Da)>
SPRと同じサンプルをITCで分析した事例です。
観測された熱量変化(左図)を解析することで、各パラメータを取得できます。
この相互作用はエンタルピー優勢の結合様式であることがわかり、水素結合や静電相互作用が寄与していると考察できます。
STD-NMR (Saturation Transfer Difference-NMR)
「申請資料の信頼性の基準」対応
低分子化合物側の相互作用部位を分析するのに優れた手法
原理
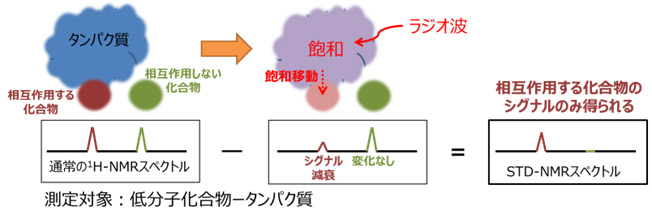
STD-NMRは、タンパク質の磁化を選択的に飽和させ、相互作用している低分子化合物に飽和が移動することによるNMRシグナルの強度変化を観測する手法です。
相互作用する化合物の、タンパク質に近い部分、つまり相互作用部位の情報を得ることができます。
模式図のように、相互作用する化合物としない化合物が混在している場合は、相互作用している化合物のシグナルのみがSTD-NMRスペクトルで確認されます。
特徴
- 非ラベル化、非固定化
より自然に近い状態での分析ができる - 相互作用部位
原子レベルで相互作用部位の情報が得られる
低分子医薬品開発における、有用な構造情報 - タンパク質の分子量の制限なし
分析例
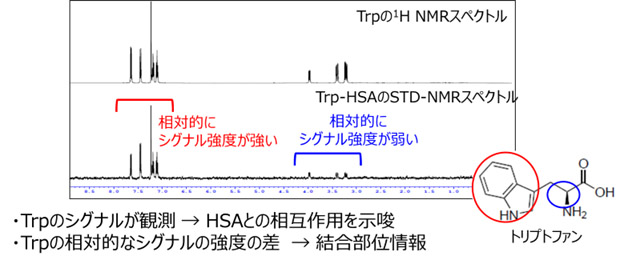
<トリプトファン(Trp)-ヒト血清アルブミン(HSA)>
上段のトリプトファンのスペクトルに対して、下段のSTD-NMRスペクトルにおいても、トリプトファンのシグナルが観測されていることから、HSAと相互作用していることがわかります。
さらに、インドール部分のシグナル強度が相対的に強いことから、この部分がHSAとの相互作用に積極的にかかわっている部位であると推定できます。
15N-HSQC(Heteronuclear Single Quantum Coherence)perturbation
「申請資料の信頼性の基準」対応
タンパク質側の相互作用部位を分析するのに優れた手法
原理
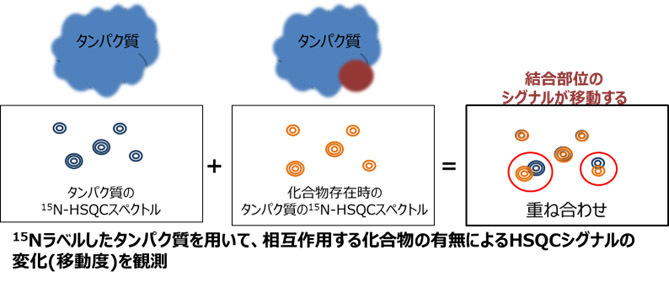
NMRを用いた15N-HSQC perturbationは、15Nラベルしたタンパク質を用いて、タンパク質のみの15N-HSQCスペクトルと、化合物存在時の15N-HSQCスペクトルを取得します。両者のスペクトルを比較し、移動したシグナルを解析することでタンパク質側の相互作用部位を明らかにする手法です。
STD-NMRに対して、タンパク質側の相互作用部位の情報が得られるため、こちらも低分子医薬品開発においては、非常に有用な構造情報となります。
特徴
- タンパク質側の相互作用部位
- タンパク質のNMRシグナルの帰属情報が必要
- 15Nラベル化したタンパク質が必要
- タンパク質の分子量制限あり
高速原子間力顕微鏡(高速AFM:High-Speed Atomic Force Microscopy)
分子レベルの構造変化などを動画として観察できる手法
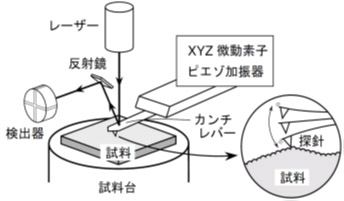
原理
原子間力顕微鏡(AFM)は、試料表面を探針でなぞって画像化し、ナノメートルレベルの分解能を有する顕微鏡で、画像取得速度が速い高速AFMは、連続で取得した画像を繋ぎ合わせて動画を得ることができます。弊社では、世界最高の画像取得速度を有する、高速AFM-NanoRacer(ナノレーサー)ーを保有し、生体分子の構造やダイナミクスをリアルタイムで観察(可視化)することができます。
特徴
生体分子の構造やダイナミクスをナノメートルレベルの高空間分解能でリアルタイム観察(可視化)できる唯一の手法。
高速AFM:1画像取得に1分以下
一般AFM:1画像取得に5~10分
観察例
タンパク質の高次構造変化、DNA鎖の切断、抗原抗体反応
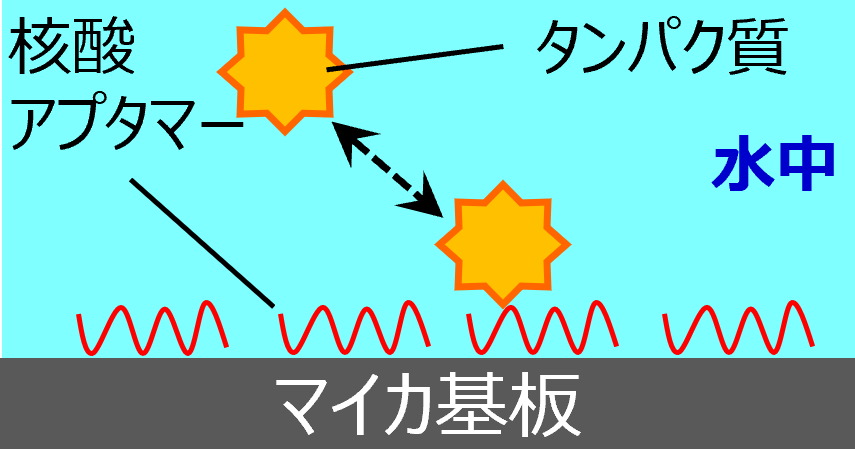
<タンパク質と核酸アプタマーを用いた測定例>
基板上に固定した核酸アプタマーに対するタンパク質の相互作用を水中で測定した例です。
大きさ10 nm程度のものが表れる・消える様子が確認できます。明るい部分は結合したタンパク質であり、タンパク質が核酸アプタマーに結合・解離する様子をリアルタイムに観察できています。さらに、タンパク質濃度を振った時の高低差変化を調べることで、解離定数を評価することができます。
分子動力学(MD:Molecular Dynamics)シミュレーション
分子の動きをコンピュータ上で再現する手法
原理
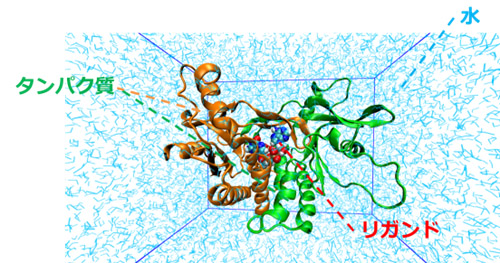
分子動力学シミュレーションは分子の動きをコンピュータ上で再現する手法です。
初期構造を設定し、各原子にかかる力を計算します。力を受けた原子についてニュートンの運動方程式を用いて、一定時間後の原子の位置を計算することができます。この「力の計算」と「運動方程式による原子位置の更新」を繰り返すことで、原子・分子の動きをシミュレーションすることができます。
MDシミュレーションでは、生体分子のダイナミクスを再現することができ、水中でのタンパク質の振る舞いやタンパク質とリガンド分子との相互作用を解析することが可能です
特徴
- タンパク質-リガンド複合体のシミュレーションからタンパク質とリガンド分子との結合親和性を計算可能
- 実験では取得が難しいタンパク質の各アミノ酸残基の相互作用への寄与について情報を得ることが可能
シミュレーション事例
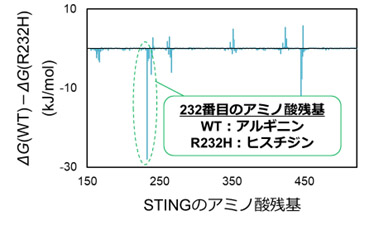
野生型(WT)と変異体(R232H)の2種類のSTINGタンパク質に対するcGAMPの相互作用の違いをMDシミュレーションで分析した事例です。
MDシミュレーションからSTINGタンパク質とcGAMPとの結合自由エネルギーを計算し、タンパク質の各アミノ酸残基の相互作用への寄与を解析しました。
その結果、232番目のアミノ酸残基の変異が野生型と変異体の結合自由エネルギーの差に大きく寄与していることが確認されました。